默沙东:帕博利珠单抗治疗宫颈癌获 FDA 优先审评
2018 年 3 月 14 日,默沙东公司宣布美国 FDA 接受了该公司为抗 PD-1 疗法 KEYTRUDA (pembrolizumab) 递交的补充生物制剂许可申请,并且授予其优先审评资格。这项申请的适应症为用户治疗接受化疗之后癌症继续恶化的晚期宫颈癌患者。
这是 FDA 接受的第 14 项关于 pembrolizumab 的监管申请,FDA 预计将在今年 6 月 28 日之前完成对这项申请的审查工作。(via 药明康德)
目前,pembrolizumab 在国内正处于上市申请阶段,Insight 数据库临床实验数据显示,国家临床试验登记与信息公示平台显示的 Pembrolizumab 在中国开展的临床试验的情况共8项,涉及肺癌、黑色素瘤、胃癌、食管癌、肝细胞癌等5大肿瘤类型。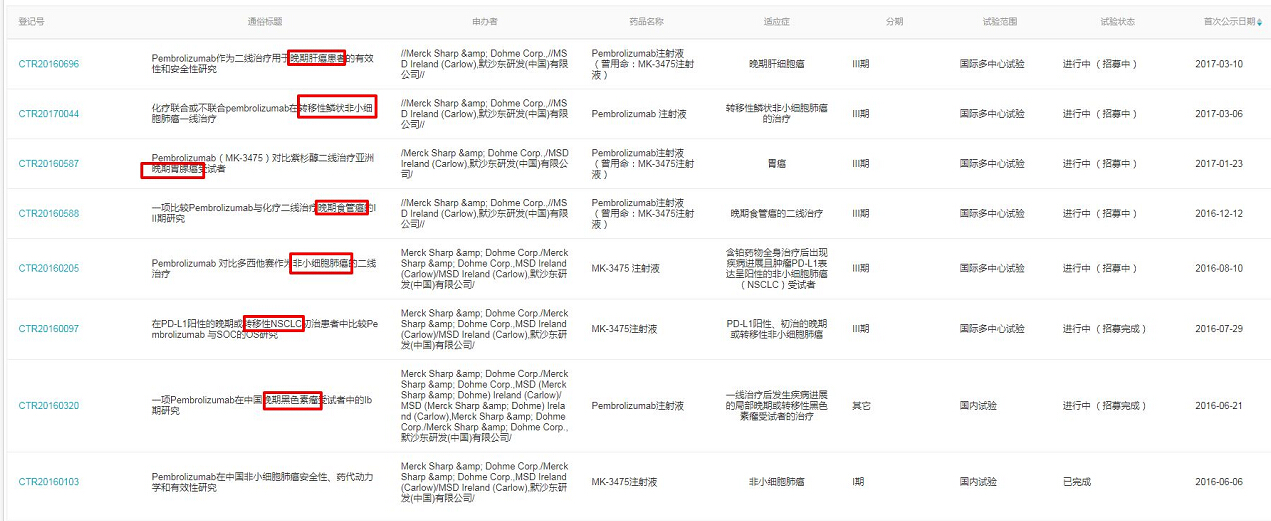
CDE 发布《药物注射剂研发技术指导意见》
3 月 13 日,为了严格药物注射剂审评审批有关要求,CDE 制定了《药物注射剂研发的技术指导意见》。
对注射剂剂型原则、剂型转换、说明书管理进行严格的规定和监管说明,提出注射剂应围绕疾病治疗需求并结合药物理化学性质合理研发。对于改规格、改剂型、改盐基注射剂的开发,从药物的安全性、有效性、稳定性考虑,应具有明显的临床优势。(via CDE)
艾伯维子宫肌瘤新药 3 期临床试验达主要终点
今日,艾伯维(AbbVie)与 Neurocrine Biosciences 宣布,其子宫肌瘤在研新药 elagolix 的 3 期临床研究 ELARIS UF-II(M12-817)达到了主要终点。此次研究证实了第一项试验的结果,显著减少了子宫肌瘤患者的重度月经出血,达到了研究的主要终点。
子宫肌瘤,也称为平滑肌瘤或肌瘤,是非癌性,激素反应性子宫肌肉组织肿瘤。子宫肌瘤是女性骨盆中最常见的异常生长,可影响约 20-80% 的 50 岁以下的女性。(via 药明康德)
药品研发重大事件
● 科伦药业重组抗 VEGFR2 全人源单克隆抗体注射液获批临床
今日,科伦药业子公司博泰生物研发的全人源单克隆抗体药物获批临床,受理号为 CXSL1600119。
本品是美国礼来公司 Ramucirumab(中文通用名:雷莫芦单抗,英文商品名:Cyramza)的生物类似药,目前国内尚无同靶点单抗药物上市。
Cyramza 是全球第一个获批的靶向 VEGFR2(血管内皮生长因子受体 2)的全人源化单抗药物,通过阻止 VEGF 与血管内皮生长因子受体 2(VEGFR2)结合,产生抗血管生成作用。该药于 2014 年在美国、日本和欧盟获批上市,能显著改善不可手术切除或转移性胃癌或胃食管连接部腺癌患者的总生存期(OS),2015 全球销售额超过 3.8 亿美元,预测 2020 年全球销售额将超过 13.4 亿美元。
本品申报适应症为中国高发恶性肿瘤胃癌、非小细胞肺癌、结直肠癌。(via 科伦医药)
以上资讯来源于 Insight 数据库(https://db.dxy.cn)医药新闻模块