去唾液酸糖蛋白受体(ASGPR)的研究进展
去唾液酸糖蛋白受体(ASGPR)
去唾液酸糖蛋白受体(ASGPR)众所周知,它也被称为“Ashwell–Morell”受体,最早从哺乳动物凝集素中发现[1]。ASGPR可以特异性高效的识别含有非还原半乳糖或者N-acetylgalactosamine为末端的糖蛋白或分子;细胞纤连蛋白、亲血栓成分、肝脂蛋白和血清免疫球蛋白-A的摄取是ASGPR的另一个功能[2]。ASGPR与病原体细胞成分的关联也是人们感染肝脏疾病的根本原因。 1.1 ASGPR的表达 ASGPR基于肝细胞而进行表达。ASGPR也被肝细胞以外的细胞检测到,分别是腹腔巨噬细胞、大鼠和人的睾丸、人类精子、人类肠道上皮细胞和外周血单核细胞等。还有报道大肠癌的形成是肝转移导致,也表达ASGPR[3]。尽管如此,肝细胞ASGPR表达远远超过体内其它位置ASGPR的表达。乙醇,四氯化碳,脂多糖和抗Fas抗体损害肝的ASGPR表达。糖尿病状态和部分肝切除也是造成ASGPR功能障碍的原因[4]。体外ASGPR在各种细胞系被表达,人肝癌细胞HepG2揭示达到76000的密度,而HepAD38则表达17000ASGPR/肝细胞。HuH-7、HuH-6连同其他来源的肝癌细胞系的亚克隆BNLCL2和HuH-5-2表达约3000低密度的ASGPR/肝细胞[5]。 1.2 ASGPR与配体的结合 在人类ASGPR中存在46kDa和50kDa两种不同的多肽亚基。每个亚基是II C型跨膜蛋白,糖识别域(CRD)被认为是ASGPR和非还原半乳糖残基和N-乙酰半乳糖胺相互识别重要的部分。钙离子则是ASGPR与甘氨酸共聚物相互作用必不可少的[6]。ASGPR中CRD有三个结合钙离子的位点,具有低结合亲和性[7]。受体钙离子与配体氧原子之间配位键相互作用的原子距离为2.8-3.0埃[8](图1)。 众所周知,半乳糖受体或肝凝集素ASGPR对Gal和GalNAc呈现高的亲和力。天冬氨酸241、天冬氨酸265、天冬酰胺264、谷氨酸252、谷氨酰胺239、色氨酸243的氨基酸质心,属于ASGPR的H1型亚基主动结合配体的位点。受体的酰胺键和羧基侧链需要与半乳糖3位与4位羟基上的氢进行结合[9]。天然配体,例如阿拉伯半乳聚糖和普鲁兰多糖表现出多于10倍的氢键,归于它们的糖二聚体。随着寡聚糖的三触角结合,ASGPR亚基的一个硅片上的三维结构也被预测到[10]。

Fig. 1. Binding of Gal to H1 subunit ofASGPR. Reproduced from. 1.3 ASGPR的内化 ASGPR跨肝细胞脂双层与配体相互作用,在质膜表面网格蛋白形成囊泡及配体通过网格蛋白介导的内吞作用而内化。Gal/GalNAc与ASGPR是在pH为6以及钙离子存在的情况下结合的。一个配体被ASGPR识别或附着由周围萌芽膜的网格小窝蛋白所促发。结合后,ASGPR迅速内化及一阶数率常数为3.4×108和约三分钟的半衰期。Dynamin-多域鸟苷-5’三磷酸腺苷,由5’水解三磷酸鸟苷从血浆中自组装螺旋成约100–120 nm的网格蛋白小泡。完全内化,网格蛋白涂层脱落的热休克蛋白和可重复使用。多个这样的核内体融合形成多个管状室和pH值约为6的囊泡。然后,他们被分类回收内涵体和早期溶酶体小泡,含有溶酶体酶从高尔基体形成成熟的溶酶体。pH 5.4的溶酶体减弱钙离子的结合力,从ASGPR-配体复合物中释放配体。去唾液酸糖蛋白配体降解而ASGPR幸免于溶酶体破坏。货物易受各种理化常数影响,如解离常数和配体密度等。循环内涵体可以保护质膜表面的ASGPR。不管内吞过程如何,半衰期研究表明ASGPR存在质膜上约20小时。
靶向ASGPR的配体
基于糖的配体表现出与以ASGPR最大的亲和力,其理化性质在配体结合中起主导作用。天然和合成的配体正在探索中。 2.1 ASGPR的配体性质 2.1.1 糖异构体 含有开放和环半乳糖的糖脂具有更长的空间臂也能结合ASGPR。环六亚甲基间隔的糖脂和脂质以及只有两个亚甲基间隔的端基糖,被发现能有效的靶向肝细胞中的基因,去唾液酸胎球蛋白前处理(AF)被阻断。有时与蛋白结合无法区分是半乳糖还是D-葡萄糖。在CRD的氨基酸序列的突变特别是3-和4-羟基突变直接导致其特异性的转化。糖直接传递到肝细胞过程中起着非常关键的作用。
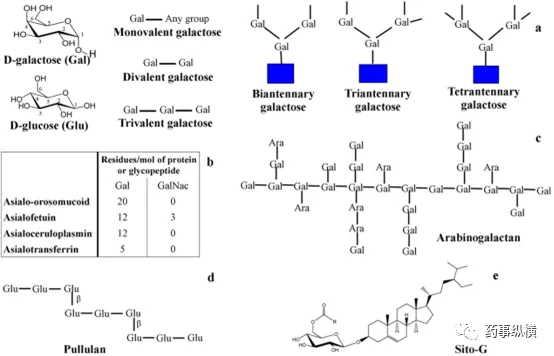
Fig. 2. Different ligands used in ASGPR targeting. 2.1.2 半乳糖密度和分支 半乳糖单触角变到三触角的时候,其亲和力增加了100-1000倍,主要归因于集群效应。除了三触角,糖量的增加也会适度提高结合度。半乳糖触角示意图如图2a。单糖显示出解离常数Kd值为10-4 M,而寡聚糖、三触角、四触角显示的Kd值分别为10-6、5×10-9、9×10-9 M。半乳糖具有更高的密度就有更高的结合强度。3-羟基和4-羟基的取代将会降低结合强度。在肝细胞中树突状氨基DNA结合实体耦合多价半乳糖的顺序是Tri-Gal>Di-Gal> Mono-Gal。 2.1.3 带有分支的半乳糖空间几何性质 糖间距显著影响带有支链的半乳糖结合程度,其结合度顺序分别是30-20埃>10埃>4埃。体外肝细胞竞争性抑制常数,其中半乳糖苷糖间距4埃的为390 μM,而20埃的为0.2 μM。至少在ASGPR中有3个半乳糖的几何形状被定义,以及对于3个互动的结合位点需要25-30埃的间距。在距离25埃时,同时结合多个位点被排除。运用适当的间距,三价和六价半乳糖胺都展出高摄取率。然而增加每个配体半乳糖胺的数量,亲和力只有小量的提升。 2.1.4 半乳糖连接 糖蛋白和具有β-终端(β1-4)的糖类似内源性配体如唾液酸血清类粘蛋白(ASOR)揭示了对于ASGPR的高亲和力。α-半乳糖和β半乳糖新糖蛋白也展出ASGPR的亲和力。然而α3半乳糖即半乳糖1-3半乳糖β1-4揭示了整个肝细胞ASGPR亲和力下降50-250倍。此外,在α3分枝未能显示任何ASGPR的结合,可能改变了C3-OH的空间排列。 2.1.5 钙离子结合,亲水/疏水平衡 随着研究,钙离子在ASGPR当中起到的作用也慢慢得到关注。疏水性ASGPR配体加入亲水性基团可以是混入的脂质保持稳定。不过,优化疏水性是先决条件。5%摩尔的tri-Gal-cholesterol的载入修饰疏水性脂质体揭示了ASGPR的介导摄取,抑制AF的存在;提高到50%摩尔的tri-Gal-cholesterol的载入,便不存在明显AF的抑制。此外,引入许多半乳糖单元造成从内源性部分全身循环后ASGPR配体的清除。 2.2 阻断ASGPR结合 ASGPR胞质尾部的离子结合会干扰细胞内信号,除了钙以外。在三磷酸腺苷、碱性化学品的消耗时,ASGPR会灭活,增加内涵体的pH。静脉注射约10~27 μM的半乳糖时,ASGPR结合也同样被阻断。 2.3 天然配体 2.3.1 糖蛋白
ASGPR内源性的糖蛋白asialoorosomucoid脱唾液酸血清类粘蛋白ASOR 和asialofetuin去唾液酸胎球蛋白AF得到广泛探索研究(图2b)。ASOR包含5个支链的碳水化合物单元,而AF是个三触角糖单元。ASOR由血清类粘蛋白的唾液酸化治疗或使用神经氨酸酶而获得,而胎球蛋白糖蛋白从胎牛血清中获得。ASOR和AF被广泛研究用于递送基因和蛋白质。乳铁蛋白,转铁蛋白家族铁结合阳离子糖蛋白,显示非常高的亲和肝细胞上的ASGPR(Kd约80 nM)。它的结合方式类似钙离子,但内化机制取决于半乳糖。
2.3.2 碳水化合物 碳水化合物配体能使ASGPR介导靶向得到充分证明。阿拉伯半乳糖(AG),一个半乳糖聚合物及普鲁兰多糖,以葡萄糖为基础的聚合物是ASGPR介导靶向得到广泛研究的对象。这些碳水化合物结合ASGPR是在钙离子存在的情况下发生的。AG是从叶松悬铃木分离出,显示出约80%摩尔的高半乳糖密度(图2c)。然而,去唾液酸胎球蛋白(AF)能完全抑制AG与ASGPR结合[59]。大鼠体内静脉注射荧光标记的AG揭示ASGPR介导,约有3.8分钟的半衰期快速消除。AG的抗转移活性可以为肝癌的治疗提供有力的条件。 普鲁兰多糖是葡萄糖的聚合物,平均分子量在58.3到200千道尔顿之间(图2d),同时也被美国FDA批准可以用于口服。它是无毒、非突变和非致癌性的。静脉注射普鲁兰多糖用于肝摄取是剂量依赖性的,肝细胞积累量是非实质细胞的两倍多。普鲁兰多糖的摄取是低于AG和AF的。 其他的碳水化合物聚合物也被探索用于ASGPR介导靶向。果胶包含D-半乳糖醛的重复单元酸部分。粒径约300纳米的载有5-氟尿嘧啶的果胶纳米粒子HepG2细胞摄取强于A549细胞,表明是ASGPR介导的摄取。β谷甾醇β-D-葡糖苷或SITO-G是带有葡萄糖残余物的大豆固醇葡糖苷的主要成分(图2e)。多柔比星脂质体(200-227.4纳米)轴承SITO-G具有较高的肝脏蓄积。去唾液酸血浆铜蓝蛋白,循环细胞纤连蛋白和葡聚糖是ASGPR其他可能的配体。 2.4 合成的ASGPR配体 2.4.1 修饰的聚合物和脂类 聚合物和脂质的半乳糖基为设计载药肝细胞特异性靶向载体提供了机会,如果聚合物是可生物降解的将是其特别的优点。静脉给药揭示了一个较高的半乳糖多聚谷氨酸肝细胞摄取,半乳糖-牛血清白蛋白(BSA)共同施用,摄取显著抑制。单价或多价的糖肽配体的合成对于ASGPR介导的肝细胞摄取也有报道。
ASGPR介导靶向策略
3.1 通过被动网状内皮系统 网状内皮系统(RES)起着先天免疫防御的作用,包括移动的和固定组织的巨噬细胞、单核细胞以及肝、脾、骨髓、淋巴结的特殊内皮细胞。肝占主导地位,占约80%的巨噬细胞,表现为固定组织巨噬细胞及主要的Kupffer细胞(KC)。它们识别,过滤和摧毁颗粒,死细胞,异常细胞,异物,病毒,细菌等,防止体内循环扩散。肝和脾的RES主要消除静脉注射颗粒尺寸大于200纳米的纳米载体。疏水性和阳离子微粒很容易被血浆激活,导致快速被清道夫受体或调理素介导吞噬。若想逃过RES,就得考虑粒子的粒径、形状和电荷等。 3.2 药与配体耦合 拥有DNA的ASOR(内源性配体)的共价耦合通过电荷-电荷相互作用偶联到聚(L-赖氨酸)PLL被首次得到证实。体内抗体到内源性糖蛋白的发展和HSA/ BSA这些配体导致耦合物的失活及发生过敏性疾病。特别是蛋白质之间的耦合可以很容易地通过肝血窦肝细胞使受体介导的内吞作用发生。尽管ASOR和AF这些天然配体得到评估显而易见,一系列合成的配体也正被研究着。 3.3 纳米载体 胶体粒子是有用的药物载体, 被动靶向于肝,归因于它们的尺寸及它们将药物运送到病灶部位的能力。此外,它们也保护药物,防止降解,同时封装疏水性和亲水药,使在需要时控制药物持续释放,以及利用独特的生物途径来实现在特定位点释放药物。使药物滞留在靶细胞和克服外排蛋白是纳米载体另一个重要的特征。配体介导的递送药物至靶点,有利于减少毒副作用,是纳米载体一个关键属性。 3.3.1 影响摄取纳米载体的性质 纳米载体的性质可以显著影响它们的体内生物分布,因此起到至关重要的作用。理想的纳米载体和靶向配体将是一个实现高药物输送到肝细胞,几乎不到其他组织器官。无毒成分的纳米载体的生物降解是很重要的,以利于排除毒性成分。 3.3.1.1 粒子大小 粒径对生物分布的影响尽管研究了许多年,但是常常还会出现矛盾。长循环标记的脂质体含有糖脂(1-50%,尺寸为30nm)导致肝特异性(85±7%)。然而粒径大于70纳米不被ASGPR识别与处理。尺寸为50nm和140nm 、略有阴离子电荷和表面半乳糖密度(25-30皮摩尔/平方厘米)的PEG化半乳糖纳米颗粒经基因传递,导致50nm颗粒累积在肝细而140 nm颗粒积累在KC。涂有AF粒径5nm的金纳米粒子或半乳糖规模的BSA揭示肝脏的非实质细胞摄取17nm的粒子和那些达到7.8nm的粒子由肝细胞摄取。虽然肝细胞靶向一直没有证明,ASGPR介导的摄取被预测。 3.3.1.2 电荷 带正电荷的聚合物如PLL在很大程度上被传递到肝细胞,由于它的阴离子基团正好与ASGPR的结合位点相互作用。Lac-PLL静脉注射10分钟内表现出98%的肝细胞摄取。阴离子与阳离子比例从1.0:2.0到1.0:3.1的脂质复合物通过ASGPR被肝细胞摄取越来越高。磁性脂质体表明修饰有阴离子脂质后,它就不在被肝细胞内化。 3.3.1.3 亲水性 亲水性或隐形纳米载体很容易逃过RES,具有长循环和更多肝细胞积累量的特点。PEG是评估出来最流行的隐形试剂。脂质体结合含有19个氨基酸肽的PEG链才更稳定有效地抗疟原虫,在肝细胞积累量约80%。不同PEG化的半乳糖脂质体靶向肝细胞,这些PEG的平均分子量350-2000千道尔顿。有报道普鲁兰多糖可以作为ASGPR的一个隐形配体。 3.3.1.4 配体浓度 肝摄取受绝对配体浓度的影响。高半乳糖配体浓度会引起ASGPR介导摄取的饱和。如前面提到的ASGPR的摄取未受半乳糖密度影响,然而更多的受体参与与配体结合,会导致暴露的ASGPR受体耗尽,肝细胞内外置换时间将会为20分钟。这种情况下,粒子就有可能被其他类似半乳糖受体的KC摄取。 静脉注射的纳米粒子和脂质体大部分很迅速的被肝的KC从循环中清除。但是,配体修饰的脂质体靶向肝细胞使用到低分子量的糖脂被ASGPR识别。pH敏感的DOPE的阳离子脂质体能进一步加快DNA的内体逃逸,以减少退化和增加转染效率。在脂质体中,半乳糖密度比半乳糖枝化对ASGPR靶向发挥的作用更大。 越来越多的树枝状纳米载体被探索用于ASGPR靶向。树枝状聚合物的星状超支化及巨大的潜力,广泛的用于靶向递送。研究了载有α-环糊精的聚酰胺胺(PAMAM)树枝状聚合物上修饰有不同程度的半乳糖基被HepG2细胞的摄取影响。半乳糖和Lac-环糊精功能化的树枝状聚合物能使核酸通过ASGPR传递到肝细胞。
总结
纳米载体和靶向药物传递是同源的。在纳米载体上锚定ASGPR配体可以为肝细胞特异性靶向传递提供有力的先决条件,进一步为ASGPR细胞内介导传递提供可能。
参考文献
[1] Grewal PK.The Ashwell–Morell receptor [J]. Methods Enzymol, 2010, 479:223-241. [2] Stockert RJ.The asialoglycoprotein receptor: relationships between structure, function, andexpression [J]. Physiol Rev, 1995, 75(3):591-609. [3] Harris RL,van den BergCW, Bowen DJ.Bowen, ASGR1 and ASGR2, the genes that encode the asialoglycoprotein receptor (Ashwell receptor), areexpressed in peripheral blood monocytes and show interindividual differences intranscript profile [J]. Mol Biol Int, 2012,2012:10-17. [4] Dodeur M,Durand D,Dumont J,et al. Effects of streptozotocin-induced diabetes mellitus on the binding anduptake of asialoorosomucoid by isolated hepatocytes from rats [J]. Eur J Biochem, 1982,123(2):383-387. [5] Li Y,Huang G,Diakur J,et al. Targeted delivery of macromolecular drugs: asialoglycoprotein receptor(ASGPR) expression by selected hepatoma cell lines used in antiviral drugdevelopment [J]. Curr Drug Deliv, 2008,5(4):299-302. [6] Zhang YT, BucklesE, WhittakerGR. Expression of the C-type lectins DC-SIGN or L-SIGN alters host cellsusceptibility for the avian coronavirus, infectious bronchitis virus [J].2012, 157(3-4):285-293. [7] Onizuka,Shimizu H,Moriwaki Y,et al. NMR study of ligand release from asialoglycoprotein receptor undersolution conditions in early endosomes [J]. FEBS J, 2012, 279(15):2645-2656. [8] D'Souza AA,Jain P,Galdhar CN,et al. Comparative in silico-in vivo evaluation of ASGP-R ligands for hepatictargeting of curcumin Gantrez nanoparticles [J]. AAPS J, 2013, 15(3):696-706. [9] Wu J,Nantz MH,Zern MA.Targeting hepatocytes for drug and gene delivery:emerging novel approaches andapplications [J]. Front Biosci, 2002, 7:17-25. [10] Ramadugu SK,Chung YH,Fuentes EJ,et al. In silico prediction of the 3D structure of trimeric asialoglycoproteinreceptor bound to triantennary oligosaccharide [J]. J Am Chem Soc, 2010, 132(26):9087-9095.
来源:药事纵横